Reaksi
substitusi adalah suatu reaksi penggantian gugus fungsional pada senyawa kimia
tertentu dengan gugus fungsional yang lain. Reaksi substitusi dapat terjadi pada substrat karbon yang bermuatan positif
(karbonium) dengan spesi yang menyenangi muatan positif atau spesi yang
kelebihan elektron (muatan negatif) atau yang dikenal dengan nukleofil,
sehingga reaksi yang terjadi disebut dengan reaksi substitusi nukleofilik (SN).
Selain itu, reaksi substitusi juga dapat terjadi pada substrat karbon yang
menyenangi muatan negatif atau spesi yang kekurangan elektron (muatan positif)
atau yang dikenal dengan elektrofil, sehingga reaksi yang terjadi dikenal
dengan reaksi substitusi elekrofilik (SE).
A. Reaksi Substitusi Nukleofilik
Reaksi yang
berlangsung karena penggantian satu atau lebih atom atau gugus dari
suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi
substitusi melibatkan nukleofil, maka reaksi disebut substitusi Nukleofilik (SN),
dimana S menyatakan substitusi dan N menyatakan nukleofilik. Spesies
yang bertindak sebagai penyerang adalah nukleofil (basa
Lewis), yaitu
spesies yang dapat memberikan pasangan elektron ke atom lain untuk membentuk
ikatan kovalen. Perubahan yang terjadi pada reaksi ini pada dasarnya
adalah: suatu nukleofil dengan membawa pasangan elektronnya menyerang
substrat (molekul yang menyediakan karbon untuk pembentukan ikatan
baru), membentuk ikatan baru dan salah satu substituen pada atom karbon
lepas bersama berpasangan elektronnya. Gugus pergi
adalah
substituen yang lepas dari substrat, yang berarti atom atau
gugus apa saja yang digeser dari ikatannya dengan atom karbon. Substrat
bisa bermuatan netral atau positif, sedangkan nukleofil bermuatan netral atau
negatif. Pada umumnya nukleofil adalah ion yang bermuatan negatif (anion),
tetapi beberapa molekul netral dapat pula bertindak sebagai nukleofil, contoh: H2O,
CH3OH, dan CH3NH2. Hal ini disebabkan karena molekul-molekul netral
tersebut, memiliki pasangan elektron menyendiri yang dapat digunakan untuk
membentuk ikatan sigma dengan atom C substrat. Dalam reaksi substitusi nukleofilik
bila nukleofilnya H2O atau -OH disebut reaksi hidrolisis, sedangkan bila
nukleofil penyerangnya berupa pelarut disebut reaksi solvolisis. Ion atau
molekul yang merupakan basa yang sangat lemah, seperti Iˉ, Clˉ, Brˉmerupakan
gugus pergi
yang baik, karena mudah dilepaskan ikatannya dari atom C
substrat. Sedangkan nukleofil yang baik adalah nukleofil yang berupa basa kuat.
v
Reaksi substitusi nukleofilik unimolekuler (SN1)
Reaksi substitusi nukleofilik unimolekuler
(SN1) terjadi melalui dua tahapan. Pada tahap pertama, ikatan antara karbon
dan gugus bebas putus, atau substrat terurai. electron – electron ikatan
terlepas bersama dengan gugus bebas, dan terbentuklah ion karbonium. Pada tahap kedua, yaitu tahap cepat, ion
karbonium bergabung dengan nukleofil akan membentuk hasil. Diagram
perubahan energi reaksi SN1
Adapun cara mengetahui suatu nukleofil dan substrat bereaksi dengan mekanisme SN1 yaitu :
· Kecepatan reaksi tidak bergantung pada
konsentrasi nukleofil. Tahap penentu kecepatan adalah tahap pertama nukleofil
tidak terlibat. Setelah tahap ini terjadi, ion karbonium bereaksi dengan
nukleofil.
·
Jika karbon yang membawa gugus bebas
bersifat kiral, reaksi mengakibatkan hilangnya aktivitas optic (yaitu,
rasemisasi). Pada ion karbonium, hanya ada tiga gugus yang melekat pada karbon
positif. Karena itu, karbon positif mempunyai hibridisasi sp2 dan
berbentuk datar. Jadi
nukleofil mempunyai dua arah penyerangan, yaitu dari depan dan dari belakang.
Dan kesempatan ini masing-masing mempunyai peluang 50 %. Jadi hasilnya adalah
rasemit. Misalnya, reaksi (S)-3-bromo-3-metilheksana dengan air menghasilkan
alkohol rasemik.
· Jika substrat R-L bereaksi melalui
mekanisme SN1, reaksi berlangsung cepat jika R merupakan struktur tersier, dan
lambat jika R adalah struktur primer. Reaksi SN1 berlangsung melalui ion
karbonium, sehingga urutan kereaktifannya sama dengan urutan kemantapan ion
karbonium. Reaksi bergantung lebih cepat jika ion karbonium lebih mudah terbentuk.
v Reaksi substitusi nukleofilik biomolekuler (SN2)
Nukleofil menyerang dari
belakang ikatan C—X. Pada keadaan transisi, nukleofil dan gugus pergi
berasosiasi dengan karbon di mana substitusi akan terjadi. Pada saat gugus pergi terlepas dengan membawa pasangan electron,
nukleofil memberikan pasangan elektronnya untuk dijadikan pasangan elektron
dengan karbon.
Mekanisme reaksi SN2 hanya
terjadi pada alkil halida primer
dan sekunder. Nukleofil yang menyerang adalah jenis nukleofil kuat
seperti -OH, -CN, CH3O-. Serangan
dilakukan dari belakang. Nukleofil menyerang dari belakang
ikatan C-X. Pada keadaan transisi, nukleofil dan gugus pergi berasosiasi dengan
karbon di mana substitusi akan terjadi. Pada saat gugus pergi terlepas dengan
membawa pasangan elektron, nukleofil memberikan pasangan elektronnya untuk
dijadikan pasangan elektron dengan karbon. Notasi 2 menyatakan bahwa reaksi
adalah bimolekuler, yaitu nukleofil dan substrat terlibat dalam langkah penentu
kecepatan reaksi dalam mekanisme reaksi.
sedangkan stereokimia untuk reaksi SN2 yaitu:
Adapun ciri reaksi SN2 adalah:
sedangkan stereokimia untuk reaksi SN2 yaitu:
Adapun ciri reaksi SN2 adalah:
· Karena nukleofil dan substrat terlibat
dalam langkah penentu kecepatan reaksi, maka kecepatan reaksi tergantung pada
konsentrasi kedua spesies tersebut.
· Reaksi terjadi dengan pembalikan
(inversi) konfigurasi. Misalnya jika kita mereaksikan (R)-2-bromobutana dengan
natrium hidroksida, akan diperoleh (S)-2-butanol.Ion hidroksida menyerang dari
belakang ikatan C-Br. Pada saat substitusi terjadi, ketiga gugus yang terikat pada
karbon sp3 kiral itu seolah-olah terdorong oleh suatu bidang datar sehingga
membalik. Karena dalam molekul ini OH mempunyai perioritas yang sama dengan Br,
tentu hasilnya adalah (S)-2-butanol. Jadi reaksi SN2 memberikan hasil inversi.
· Jika substrat R-L bereaksi melalui
mekanisme SN2, reaksi terjadi lebih cepat apabila R merupakan gugus metil atau
primer, dan lambat jika R adalah gugus tersier. Gugus R sekunder mempunyai
kecepatan pertengahan. Alasan untuk urutan ini adalah adanya efek rintangan
sterik. Rintangan sterik gugus R meningkat dari metil < primer < sekunder
< tersier. Jadi kecenderungan reaksi SN2 terjadi pada alkil halida adalah:
metil > primer > sekunder >> tersier.
Faktor-faktor yang mempengaruhi
mekanisme SN1 dan SN2 adalah :
1. Struktur alkil halida.
Umumnya alkil halida primer bereaksi
dengan mekanisme SN2, alkil halida tersier dengan mekanisme SN1
dan alkil halida sekunder dapat dengan mekanisme SN2 dan SN1.
Hal ini disebabkan oleh kerapatan elektron pada atom karbon yang mengikat
halida. Pada alkil halida tersier terdapat tiga gugus alkil, bila alkil halida
terionisasi maka ion karbonium yang terbentuk lebih stabil, karena adanya efek
induksi dari ketiga gugus.
Pada alkil halida primer, hanya terdapat satu gugus alkil, bila alkil halida mengalami ionisasi, maka ion karbonium primer yang dihasilkan tidak stabil. Semakin stabil ion karbonium yang dihasilkan maka mekanisme reaksi SN1 semakin dominan.
Pada alkil halida primer, hanya terdapat satu gugus alkil, bila alkil halida mengalami ionisasi, maka ion karbonium primer yang dihasilkan tidak stabil. Semakin stabil ion karbonium yang dihasilkan maka mekanisme reaksi SN1 semakin dominan.
2. Sifat dari atom halogen
Sifat dari atom halogen tidak
berpengaruh pada mekanisme reaksi, hanya saja dapat mengubah laju reaksi, R-I
> R-Br > R-Cl (untuk reaksi SN1 dan SN2)
3.
Pengaruh Gugus Pergi
Gugus pergi yang baik adalah anion
stabil (basa konjugat) dan turunan dari asam kuat. Gugus pergi yang baik
biasanya adalah basa lemah.
Contoh: Ion halida (I-, Cl-,
Br). Gugus pergi yang buruk adalah gugus yang tidak bisa digantikan oleh
Nukleofil sehingga harus diubah menjadi gugus lain. Semakin lemah kebasaan
suatu gugus, kemampuan untuk pergi lebih baik. Basa lemah adalah yang baik
karena basa lemah tidak bisa berbagi elektron mereka seperti yang dilakukan
oleh basa kuat.
4. Pengaruh Nukleofilik
Nukleofil adalah sebuah spesies(ion atau molekul) yang
tertarik kuat ke sebuah daerah yang bermuatan positif pada sesuatu yanglain.
Nukleofil bisa berupa ion-ion negatif penuh, atau memiliki muatan yangsangat
negatif pada suatu tempat dalam sebuah molekul. Nukleofil-nukleofil
yangumum antara lain ion hidroksida, ion sianida, air dan amonia. Sedangkan
nukleofil yang baik adalah nukleofil yang berupa basa kuat.
PERMASALAHAN:
B. Reaksi Subtitusi
Elektrofilik
Pada
mekanisme reaksi substitusi elektrofilik senyawa aromatik, jika spesies
penyerang berupa ion positif (misalnya E+),
maka serangan pada senyawa aromatik (misalnya benzena) akan menghasilkan
karbokation yang tahap-tahapnya adalah
sebagai berikut:
Tahap 1:
Pada
tahap ini elektrofil mengambil dua elektron dari 6 elektron pada inti benzena
dan membentuk ikatan dengan salah satu atom karbon cincin benzena. Pembentukan
ikatan ini akan merombak sistem aromatik yang ada karena pada pembentukan ion
benzenonium atom karbon yang membentuk ikatan dengan elektrofil berubah dari
hibridisasi sp2 menjadi sp3 dan tidak lagi memiliki
orbital p. Keempat elektron ion benzenonium terdelokalisasi pada kelima orbital
p.
Struktur
(1), (2) dan (3) adalah struktur resonansi penyumbang pada struktur ion
benzenonium yang sebenarnya. Struktur ion benzenonium yang sebenarnya merupakan
hibrida dari struktur-struktur resonansi tersebut. Struktur (1) sampai dengan
(3) seringkali digambarkan dengan struktur (4) sebagai berikut.
Ion
arenium seringkali disebut juga dengan nama kompleks Wheland atau kompleks σ
(sigma).
Tahap 2:
Pada
tahap 2 ion benzenonium melepaskan proton dari atom karbon yang mengikat elektrofil.
Atom karbon yang mengikat elektrofil berubah kembali menjadi hibridisasi sp2
dan inti benzena memperoleh kestabilannya kembali.
Langkah
dalam tahap 2 tersebut lebih cepat daripada tahap 1, karena itu langkah penentu
laju reaksinya adalah tahap 1 dan reaksinya merupakan reaksi orde kedua. Berikut diagram perubahan reaksi SEAr
Sebelum terjadinya mekanisme reaksi SEAr , harus memenuhi :
•
Dibutuhkan
E+ yang lebih kuat dibandingkan Br2.
•
Menggunakan
katalis asam lewis kuat, FeBr3.
REFEENSI:
Amanatie. 2003. Buku Pegangan Mahasiswa Kimia Organik Fisik. Yogyakarta : UNY Press.
Carey, F.A. 2000. Organic Chemistry fourth Edition. Boston : Mc Graw Hills Companies.
Fessenden, R.J dan J.S. Fessenden. 1982. Kimia Organik Edisi Ketiga. Jakarta : Erlangga.
Fessenden, R.J dan J.S. Fessenden. 1982. Kimia Organik Edisi Ketiga. Jakarta : Erlangga.
PERMASALAHAN:
1. Jelaskan pengaruh gugus tetangga terhadap kecepatan reaksi substitusi nukleofilik, serta pengaruh oksigen sebagai gugus tetangga pada reaksi substitusi basa dari 1,2-klorohidrin menghasilkan 1,2-diol berdasarkan gambar berikut
2. Jelaskan pengaruh pelarut protik dan aprotik terhadap reaksi substitusi berdasarkan gambar berikut.
3. Jelaskan mekanisme reaksi substitusi elektrofilik pada ion arenium berdasarkan gambar berikut.













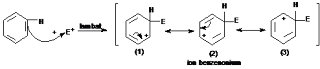














1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
BalasHapus2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
Terima kasih materinya. Menurut saya jawaban nomor 1 itu Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
BalasHapusterima kasih atas paparan materinya step
BalasHapusmenurut saya jawaban no 2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
Mksih Stef :)
BalasHapusSaya akan coba menjawab
1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
Menurut saya jawaban nomor 1 itu Pengaruh guegus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi
BalasHapusMakasih fan
BalasHapusMau jawab soal no 2 menurut saya jawaban Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.enurut saya jawaban no 2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
Hai stefani, baiklah saya akan menjawab pertanyaan no 2: Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
BalasHapusterima kasih atas paparan materinya step
BalasHapusmenurut saya jawaban no 2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
Terimakasih teps atas paparannya,
BalasHapusMenurut saya jawaban nomor 1 itu Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi.
terima kasih materinya, baiklah saya akan membantu menjawab nomor 2, yaitu Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
BalasHapusHallo stefanol
BalasHapus1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
Saya akan coba menjawab
BalasHapus1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
Materi bagus,
BalasHapus3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
BalasHapus2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
Oke stef, setelah saya berpikir maka jawabannya adalah:
BalasHapus1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
Makasih Fani atas materinya, blog nya cantik tapi orangnya lebih cantik😆.
BalasHapusBaiklah saya akan menjawab pertanyaan nya:
1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
BalasHapus2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
Ok terima kasih. Saya akan coba menjawab persoalan tersebut.
BalasHapus1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk.
Terima kasih materinya. Menurut saya jawaban nomor 1 itu Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal
BalasHapus2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
BalasHapusSaya akan coba menjawab
BalasHapus1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
Balas
Haikal Alfairuz
terima kasih materinya.
BalasHapusJawaban soal nomor 2, yaitu Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
BalasHapusmekanisme SN2.
BalasHapus3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produk
1. Pengaruh gugus tetangga dapat mempengaruhi kecepatan reaksi yaitu apabila suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai anchimeric assistance. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal.
BalasHapus2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
3. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Ion Arrenium adalah jenis karbokation yang terstabilkan oleh adanya resonansi. Dalam mekanisme tersebut langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat antara atau intermediate yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium untuk membentuk produ
Terimakasih stefani materinya, saya akan coba jawab no2. Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.
BalasHapusterima kasih materinya.
BalasHapusJawaban soal nomor 2, yaitu Apabila pelarutnya memiliki polaritas besar kecenderungan alkil halida mengalami reaksi substitusi dengan mekanisme SN1 semakin besar. Sebaliknya, bila pelarutnya memiliki polaritas kecil atau bukan polar maka kemungkinan untuk terjadinya ionisasi kecil, sehingga yang dominan adalah mekanisme SN2.